Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.

Ассоциация генов системы гемостаза с риском развития ишемического инсульта у пациентов в возрасте до 50 лет
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2018;118(9‑2): 14‑21
Прочитано: 1313 раз
Как цитировать:
Цереброваскулярные заболевания представляют собой одну из важнейших проблем в клинической неврологии. Половина всех инсультов приходится на трудоспособный возраст, и лишь около 20% выживших больных могут вернуться к прежней работе [1, 2]. Не вызывает сомнения, что одной из основных причин возникновения ишемического инсульта (ИИ) является тромбоз церебральных артерий. Этот факт привлекает особое внимание к изучению генов, которые связаны с системой свертывания крови.
Гликопротеин Ib (GPIb) — тромбоцитарный белок, который входит в состав гликопротеинового комплекса GPIb/IX/V, функционирующего как рецептор для фактора фон Виллебранда (ФВ). Полиморфизм -5Т/С гена GP1BA [3] приводит к увеличению плотности рецепторного комплекса GPIb/IX/V на мембранах тромбоцитов [4, 5], что в свою очередь может способствовать развитию тромбообразования. Результаты ряда исследований указывают на возможную ассоциацию полиморфизма -5Т/С гена GP1BA с риском развития инфаркта миокарда и ИИ [6—8], в то время как другие работы показывают негативные результаты [9, 10].
Ген F2 кодирует коагулирующий фактор II (протромбин) — основной компонент свертывающей системы крови. S. Poort и соавт. [11] описали полиморфный локус G20210A [12], который приводит к повышению уровня протромбина в крови в 1,5—2 раза по сравнению с нормальными значениями [13]. В ряде исследований [12, 14] была выявлена ассоциация G20210A полиморфизма гена F2 с риском развития тромбоза вен нижних конечностей. В отношении данного полиморфного локуса и риска развития ИИ имеются достаточно противоречивые данные [15—18].
Коагулирующий фактор V (FV) секретируется в результате активации тромбоцитов. В гене F5 присутствует полиморфный локус G1691A (мутация Лейдена), ассоциированный с устойчивостью к активированному протеину С и являющийся причиной гиперкоагуляционной активности ФВ, что может приводить к развитию тромбозов. Только несколько исследований случай—контроль обнаружили ассоциацию между мутацией и риском развития ИИ или транзиторной ишемической атаки (ТИА) [19—21], в то время как в других работах данной ассоциации не выявлено [22—24].
Результаты исследований по изучению влияния полиморфных вариантов генов GP1BA, F2, F5 на риск развития ИИ не являются однозначными [6—24]. Возможно, это связано со значительными межэтническими различиями в распределении генотипов и аллелей однонуклеотидных полиморфизмов генов в разных популяциях.
Цель настоящего исследования — изучение влияния полиморфных вариантов генов системы гемостаза на риск развития ИИ у пациентов славянской популяции в возрасте до 50 лет.
Обследовали 92 пациентов (19 женщин, 73 мужчины) в возрасте от 18 до 50 лет (средний возраст 42,2±6,7 года) с ИИ (основная группа), проходивших лечение в неврологических клиниках РНИМУ им. Н.И. Пирогова (ГКБ № 31, ГКБ № 20 Москвы).
Критерии включения в исследование: атеротромботический, лакунарный и криптогенный ИИ или ТИА; принадлежность к русскому этносу; подписание больным или его ближайшими родственниками информированного согласия. Критерии исключения: неславянское происхождения; геморрагический, кардиоэмболический ИИ и ИИ другой известной этиологии.
Контрольную группу составили 90 здоровых (45 мужчин, 45 женщин) этнически русских молодого возраста (средний возраст 26,2±3,9 года), подписавших информированное согласия на участие в исследовании (см. рисунок). 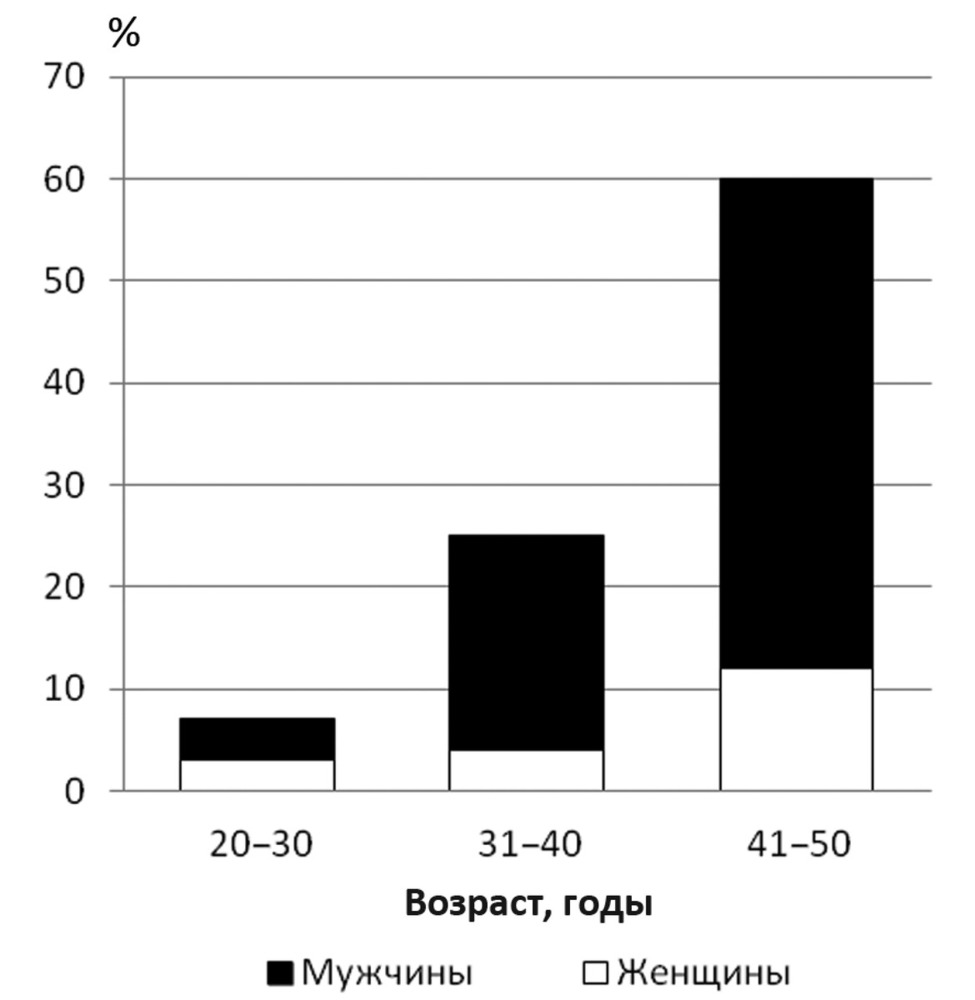
Ишемический характер инсульта подтверждался результатами нейровизуализации. Патогенетический подтип ИИ, согласно критериям TOAST [25], устанавливался на основании анамнеза развития заболевания, оценки соматического и неврологического статусов, данных клинико-инструментальных методов исследования. У всех пациентов проводился анализ семейного и индивидуального анамнеза с уточнением всех возможных факторов риска.
При поступлении в стационар в 1—2-е сутки заболевания проводились исследование биохимический анализ крови с определением уровня холестерина, триглицеридов, липопротеинов высокой, низкой и очень низкой плотности с целью выявления дислипидемии; определение уровня глюкозы крови; развернутая коагулограмма и агрегатограмма для оценки состояния реологических свойств крови; дуплексное сканирование магистральных артерий головы (МАГ) и транскраниальное дуплексное сканирование артерий основания головного мозга для выявления патологии экстра- и интракраниальных артерий.
За время пребывания в стационаре в плановом порядке проводили оральный глюкозотолерантный тест для выявления сахарного диабета или нарушения толерантности к углеводам; обследование на антифосфолипидный синдром, на наличие системных заболеваний; анализ крови на содержание гомоцистеина; трансторакальную эхокардиографию; по показаниям, для исключения парадоксальной эмболии, — трансэзофагеальную эхокардиографию.
Генетический анализ был проведен на базе отдела молекулярных основ генетики человека ИМГ РАН. Для проведения анализа использовали препараты ДНК, полученные из 3 мл венозной крови. Выделение геномной ДНК проводили с использованием набора AxyPrep Blood Genomic DNA Midiprep Kit («Axygen», США) согласно рекомендациям производителя.
Полиморфные аллели генов GP1BA, F2, F5 исследовали методом полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием технологии TaqMan (табл. 1). 
Статистическая обработка полученных данных проводилась с использованием пакета программ IBM SPSS Statistics version 19, программного обеспечения MS Excel 2000 («Microsoft», США) и программы GraphPad InStat3, с помощью которой определяли величину критерия χ2 и показателя относительного риска (ОР). Достоверными считали значения при p<0,05.
В основной группе 90 пациентов перенесли ИИ, у 2 больных отмечалась ТИА. Основные клинические особенности пациентов и распределение по патогенетическим вариантам представлены в табл. 2. 
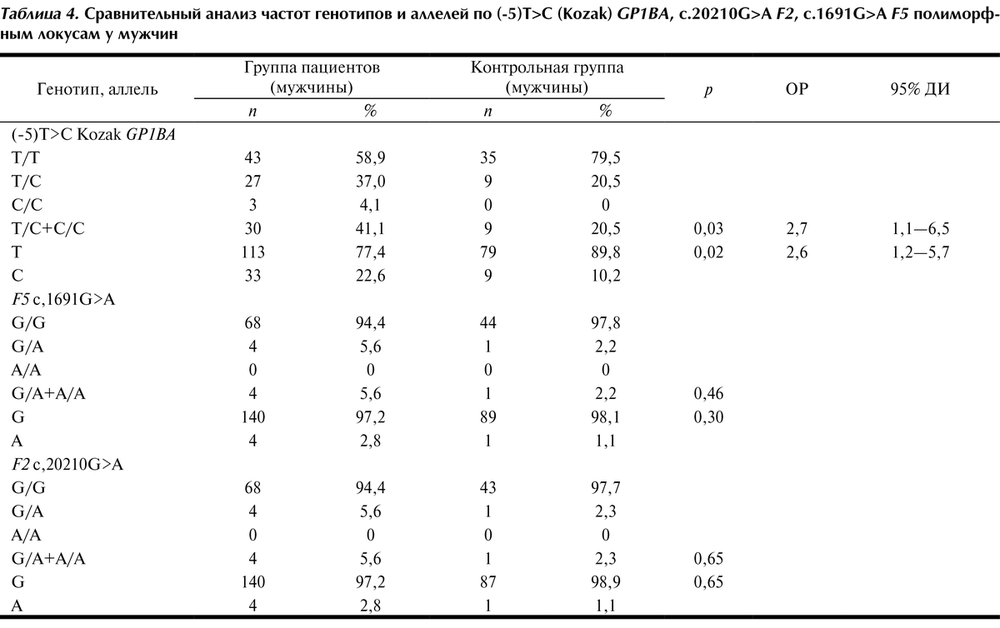
Анализ полиморфизма -5Т/С гена GP1BA показал статистически достоверное различие в распределении частот генотипов и аллелей по данному полиморфному локусу между больными и контрольной группой. В группе пациентов с ИИ достоверно чаще встречались аллель С (p=0,02; ОР=2,0; 95% ДИ 1,1—3,6) и содержащие его генотипы С/С и С/Т (p=0,04; ОР=2,0; 95% ДИ 1,04—3,8).
При анализе с учетом пола у мужчин по сравнению с контролем имело место статистически достоверное повышение встречаемости аллеля С (p=0,02) и генотипов С/С и С/Т (р=0,03). Риск развития ИИ у молодых мужчин с генотипами С/С и С/Т был увеличен более чем в 2 раза (p=0,03; ОР=2,7; 95% ДИ 1,1—6,5). Достоверных различий в распределении частот генотипов и аллелей между больными и контролем у женщин получено не было (р>0,05). Таким образом, генотипы -5С/С и -5Т/С ассоциированы с развитием ИИ у мужчин в возрасте до 50 лет. Аллель С является фактором повышенного риска развития ИИ у мужчин в молодом возрасте, в то время как у женщин этот аллель и содержащие его генотипы не являются фактором риска развития ИИ.
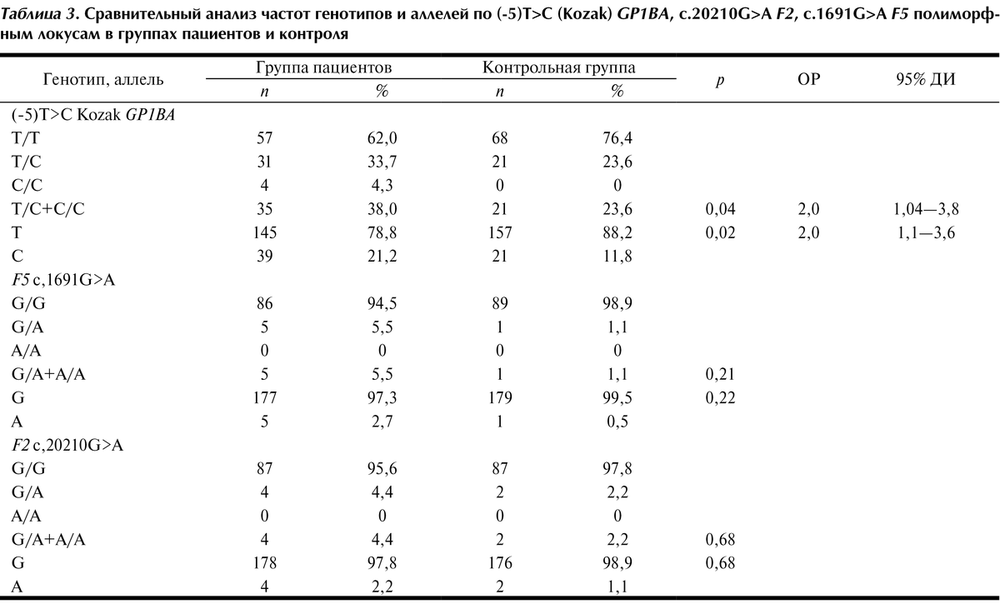
Анализ полиморфизма G20210A гена F2 и полиморфизма G1691A гена F5 не выявил достоверных различий в распределении частот генотипов и аллелей между пациентами с ИИ и контрольной группой (см. табл. 3). Также не было обнаружено различий в распределении частот генотипов и аллелей при анализе выборок с учетом пола (см. табл. 4).
На следующем этапе проводили анализ между пациентами, относящимися к различным патогенетическим подтипам ИИ, и контрольной группой. С учетом полученных данных по полиморфизму -5Т/С гена GP1BA, которые показали ассоциацию с ИИ у мужчин, этот полиморфный локус анализировали только в мужской популяции. Таким образом, при анализе распределения генотипов и аллелей полиморфизма -5Т/С гена GP1BA, полиморфизма G1691A гена F5, полиморфизма G20210A гена F2 у пациентов с атеротромботическим и криптогенным ИИ не выявили ассоциации ни с одним из изучаемых полиморфных локусов. Различия в распределении частот генотипов и аллелей между группами больных и контролем были статистически недостоверны.
При анализе пациентов с лакунарным ИИ установлено наличие ассоциации полиморфизма -5Т/С гена GP1BA и полиморфизма G1691A гена F5 с данным вариантом ИИ (табл. 5). 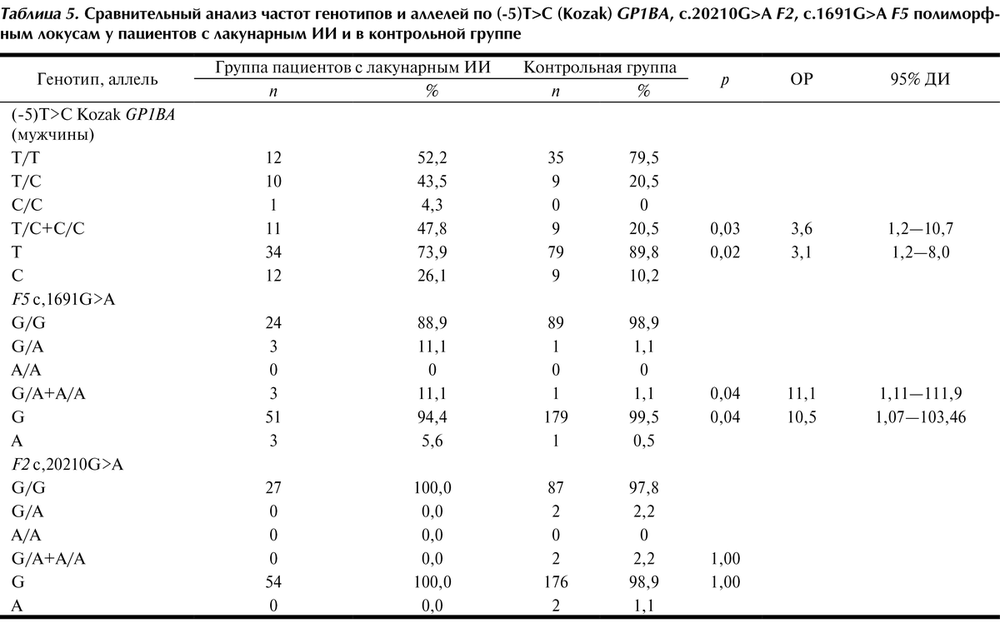
У пациентов наблюдалась более частая встречаемость аллеля С (p=0,02) и связанных с ним генотипов Т/С и С/С (p=0,03) гена GP1BA по сравнению с контрольной группой. Риск развития лакунарного инсульта у носителей генотипов Т/С и С/С был повышен более чем в 3 раза (OР=3,6; 95% ДИ 1,2—10,7). Также отмечалось наличие более частой распространенности генотипа GA и аллеля A по полиморфизму G1691A гена F5 у пациентов с лакунарным ИИ по сравнению с контрольной группой (для генотипов p=0,038; OР=11,1; 95% ДИ 1,11—111,88), для аллелей (p=0,039; ОР=10,5; 95% ДИ 1,07—103,46).
Статистически достоверных различий в распределении частот генотипов и аллелей по полиморфному локусу G20210A гена F2 между пациентами с лакунарным ИИ и контрольной группой получено не было.
Отдельно была проанализирована группа пациентов с ИИ, у которых был выявлен тромбоз каротидных или позвоночных артерий и исключен кардиоэмболический генез ИИ. У 21 больного — 18 (85,7%) мужчин и 3 (14,3%) женщин — имел место тромбоз МАГ (14 пациентов с атеротромботическим ИИ и 7 — с криптогенным ИИ) (табл. 6). 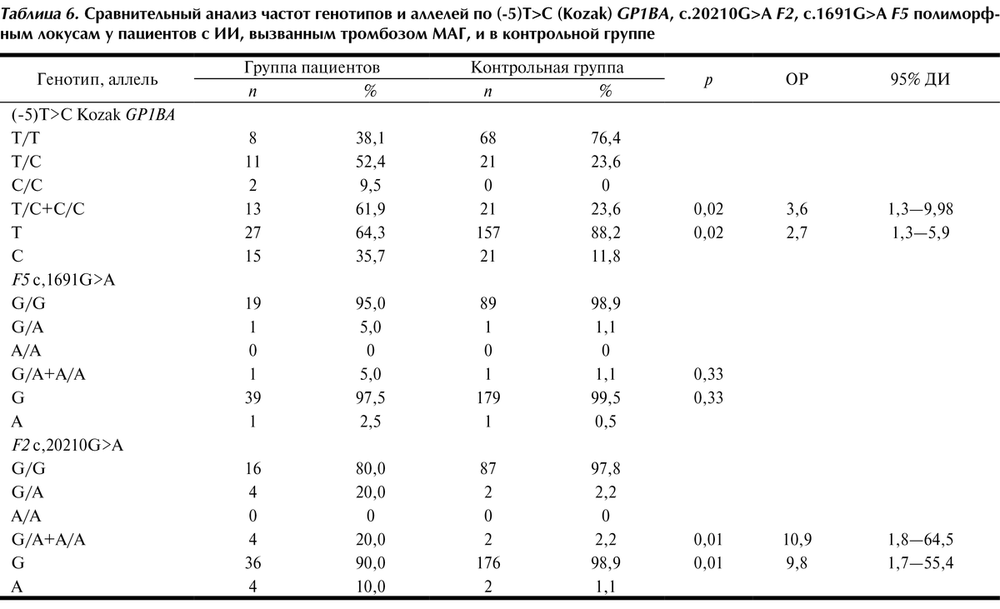
Анализ полиморфизма G20210A гена F2 у пациентов с тромбозами МАГ показал статистически достоверное различие в распространенности генотипов (p=0,01; OР=10,9; 95% ДИ 1,8—64,5) и аллелей (p=0,01; OР=9,8; 95% ДИ 1,7—55,4) у пациентов с тромбозами МАГ по сравнению с контролем.
В результате проведенного исследования можно сделать вывод, что полиморфизм -5Т/С гена GP1BA и полиморфизм G20210A гена F2 ассоциированы с риском развития ИИ, вызванного тромбозом МАГ.
При проведении молекулярно-генетического анализа полиморфизма G1691A гена F5 у пациентов с выявленными тромбозами МАГ и группой контроля статистически значимых различий в распределении частот генотипов получено не было (p=0,33).
Таким образом, все данные, полученные при анализе наличия ассоциации полиморфизма -5Т/С гена GP1BA с ИИ, указывают на то, что Т/С-полиморфизм гена GP1BA ассоциирован с развитием ИИ у мужчин молодого возраста. Фактором повышенного риска развития ИИ является аллель -5С и генотипы, его содержащие: -5Т/С и -5С/С. Кроме того, генотипы С/С и С/Т по полиморфизму -5Т/С гена GP1BA ассоциированы с развитием ИИ, вызванного тромбозом МАГ, у пациентов в возрасте до 50 лет. В данной группе пациентов отмечалось наличие выраженной тенденции к более частой встречаемости аллеля -5С и генотипов -5Т/С и -5С/С у больных с лакунарным подтипом И.И. Полученные результаты позволяют предположить, что этот полиморфный локус реализует свой протромбогенный эффект как на уровне МАГ, так и на микроциркуляторном русле, потенцируя тромбоз как крупных, так и мелких сосудов. Необходимо отметить, что отсутствие статистически достоверных ассоциаций исследуемых полиморфизмов генов с ИИ у женщин молодого возраста в настоящем исследовании связано, возможно, с небольшим числом пациентов данной подгруппы.
Результаты исследования подтверждают данные большинства метаанализов [6, 26, 27], проведенных в других странах, которые выявили ассоциацию полиморфизма -5Т/С гена GP1BA с риском развития И.И. Кроме того, они объясняют негативные результаты исследования M. Frank и соавт. [9], которое было проведено у женщин в возрасте от 18 до 44 лет с ИИ.
В нашем исследовании у женщин в возрасте от 18 до 50 лет также не было выявлено статистически значимой ассоциации с полиморфизмом -5Т/С гена GP1BA. Полученные данные могут свидетельствовать о том, что этот полиморфный локус играет роль в развитии ИИ у мужчин молодого возраста, принадлежащих к различным этническим группам.
В литературе имеются достаточно противоречивые данные об ассоциации полиморфизма G1691A гена F5 с повышенным риском развития инсульта. Так, метаанализы А. Wu и G. Tsongalis [28] и J. Casas и соавт. [29] подтверждают положительные ассоциации между данным полиморфизмом в гене F5 с ИИ, однако при этом авторы указывают на высокую гетерогенность исследований, объединенных в этих метаанализах. Другие исследования, выявившие положительные ассоциации полиморфизма G1691A гена F5 и ИИ, проводились либо на выборках небольшого объема, либо на достаточно фенотипически специализированных выборках [16—18]. Широкомасштабное мультилокусное исследование, проведенное W. Lalouschek и соавт. [30], и исследование GEOS [24] не подтвердили наличия ассоциаций полиморфизма G1691A гена F5 с риском развития ИИ. В настоящем исследовании была выявлена ассоциация между данным полиморфизмом и риском лакунарного ИИ в возрастной группе до 50 лет. Учитывая, что число пациентов данной подгруппы невелико, необходимо дальнейшее исследование для уточнения статистической достоверности.
Большинство исследований в отношении полиморфизма G20210A гена F2 не выявило ассоциации с риском развития ИИ [16, 18, 30]. Однако результаты исследовании GEOS [15] показали ассоциацию данного полиморфного локуса с ИИ у пациентов молодого возраста. В настоящем исследовании также были получены данные, что полиморфизм G20210A гена F2 не ассоциирован с риском развития ИИ у пациентов в возрасте до 50 лет. Тем не менее при анализе подгруппы пациентов с тромбозом МАГ наблюдались статистически достоверные различия в распределении частот генотипов и аллелей по сравнению с контрольной группой. Таким образом, можно сделать вывод, что данный полиморфный локус ассоциирован с риском развития ИИ, вызванного тромбозом МАГ.
У 46 (50%) из 92 больных был обнаружен хотя бы один из изученных протромбогенных полиморфных локусов. А 3 больных оказались носителями сочетания двух различных неблагоприятных аллелей в изученных генах. Наличие нескольких протромбогенных полиморфизмов оказывало аддитивный эффект и приводило к более раннему развитию ИИ либо к возникновению рецидивов заболевания у этих больных.
Результаты проведенного исследования подтвердили важную роль наследственного фактора в развитии И.И. Выявление генетических маркеров риска цереброваскулярной патологии позволяет расширить возможности ее первичной профилактики, разработать комплексные превентивные методы обследования и лечения лиц из групп риска.
ИИ нельзя рассматривать как однородную группу для оценки генетических факторов риска. Имеет смысл проводить анализ с учетом патогенетического варианта ИИ, что позволяет сделать выборку более однообразной. А у пациентов молодого возраст с учетом гормональных особенностей необходимо учитывать и пол пациентов. Дальнейшие исследования в этом направлении позволят более четко определить генетические факторы риска ишемического инсульта в разных возрастных группах.
По результатам настоящего исследования были сделаны следующие выводы:
1. Анализ полиморфного локуса -5Т/С гена GP1BA показал, что данный полиморфизм ассоциирован с развитием ИИ у мужчин молодого возраста. Фактором повышенного риска развития инсульта являлся аллель -5С и генотипы его содержащие: -5Т/С и -5С/С (p=0,04; ОР=2,0; 95% ДИ 1,04—3,8]). Также у мужчин аллель -5С и генотипы -5Т/С и -5С/С являются фактором повышенного риска лакунарного ИИ (p=0,02; OР=3,6; 95% ДИ 1,2—10,7). Кроме того, у пациентов в возрасте до 50 лет генотипы -5С/С и -5С/Т ассоциированы с развитием ИИ, вызванного тромбозом МАГ (p=0,001; OР=5,3; ДИ 1,9—14,4).
2. Анализ полиморфных локусов G1691A гена F5 и G20210A гена F2 показал, что аллель 1691A и генотип G1691A гена F5 ассоциированы с развитием лакунарного ИИ у пациентов молодого возраста (p=0,038; ОР=11,1; 95% ДИ 1,11—111,88), а аллель 20210A и генотип G20210A гена F2 ассоциированы с повышенным риском развития ИИ в результате тромбоза МАГ (p=0,01; OР=10,9; 95% ДИ 1,8—64,5) и не влияют на риск развития других патогенетических подтипов ИИ (p>0,05).
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: ekovita@mail.ru
Подтверждение e-mail
На test@yandex.ru отправлено письмо со ссылкой для подтверждения e-mail. Перейдите по ссылке из письма, чтобы завершить регистрацию на сайте.
Подтверждение e-mail
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании файлов cookie, нажмите здесь.